2025年8月6日,南宫NG28医药(2696.HK)宣布,潜在同类首创(first-in-class)人唾液酸酶融合蛋白HLX79(E-602)联合汉利康®(利妥昔单抗)治疗活动期肾小球肾炎的II期临床试验(HLX01HLX79-GN201)于中国完成首例患者给药。汉利康®现已在中国获批用于治疗非霍奇金淋巴瘤(NHL)、慢性淋巴细胞白血病(CLL)、类风湿性关节炎(RA),是现在国内唯一获批用于自身免疫疾病治疗的利妥昔单抗。此外,汉利康®亦在拉美多国获批用于治疗血管炎肉芽肿(GPA)、显微镜下多血管炎(MPA)和寻常型天疱疮(PV)等自身免疫疾病。
终末期肾病(ESRD)是慢性肾脏病(CKD)的终末阶段,这一阶段患者肾功能几乎完全丧失,需长期依靠肾脏替代治疗维持生命,具有疾病严重程度高、多并发症高发、治疗花费负担重等特点[1]。中国ESRD患者数量位居全球首位,占比接近30%,折合现有患者人数达350万[2]。而中国终末期肾病的主要病因为肾小球肾炎,包括原发性肾小球肾炎和继发性肾小球肾炎。原发性肾小球肾炎包括膜性肾病(MN)、局灶节段性肾小球硬化(FSGS)等。继发性肾小球肾炎包括狼疮肾炎(LN)、抗中性粒细胞胞质抗体(ANCA)相关性血管炎(AAV)肾损害等[1]。
近年来,以利妥昔单抗(抗CD20单抗)等靶向抗体为代表的B细胞清除疗法,已在全球多个市场获批并被中华医学会肾脏病学专家共识推荐用于治疗肾小球肾炎[1]。然而,许多患者对这类药物的治疗反应并不理想。糖免疫提供了一种治疗自身免疫疾病的新方法。该策略顺利获得酶解唾液酸糖苷,打破致病性免疫细胞的“保护屏障”, 从而增强其清除效果,帮助恢复机体免疫平衡。
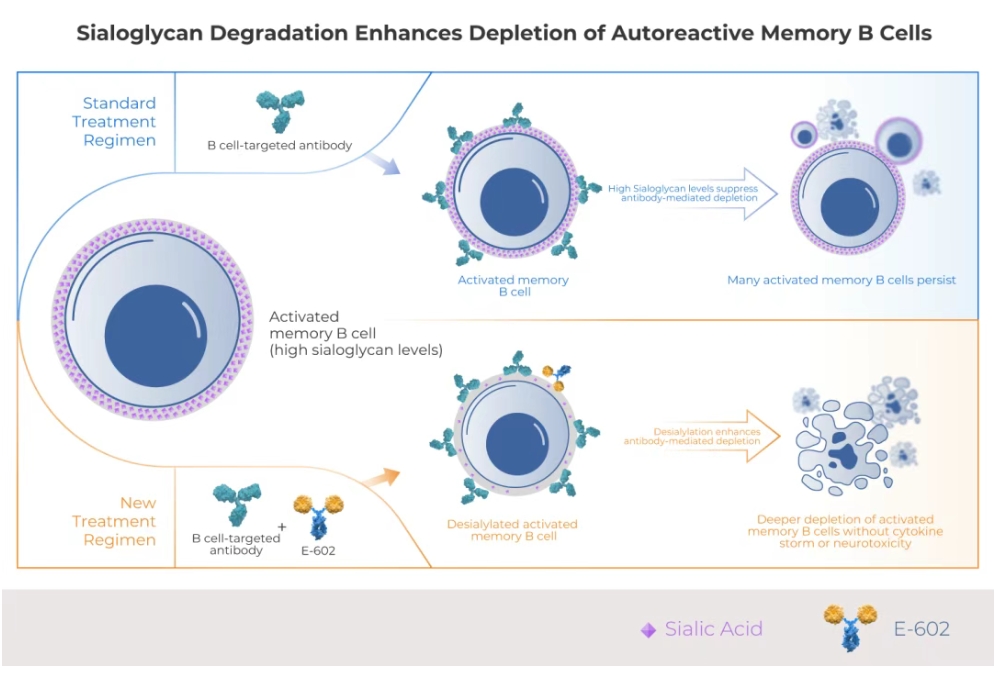
HLX79是基于Palleon的EAGLE糖编辑平台开发的潜在“同类首创”的人唾液酸酶融合蛋白。HLX79 顺利获得酶解唾液酸糖苷,从而增强对两类在自身免疫疾病中高度致病的免疫细胞的清除:一是驱动炎症的自身反应性记忆B细胞,二是促进纤维化和器官损伤的M2型巨噬细胞。
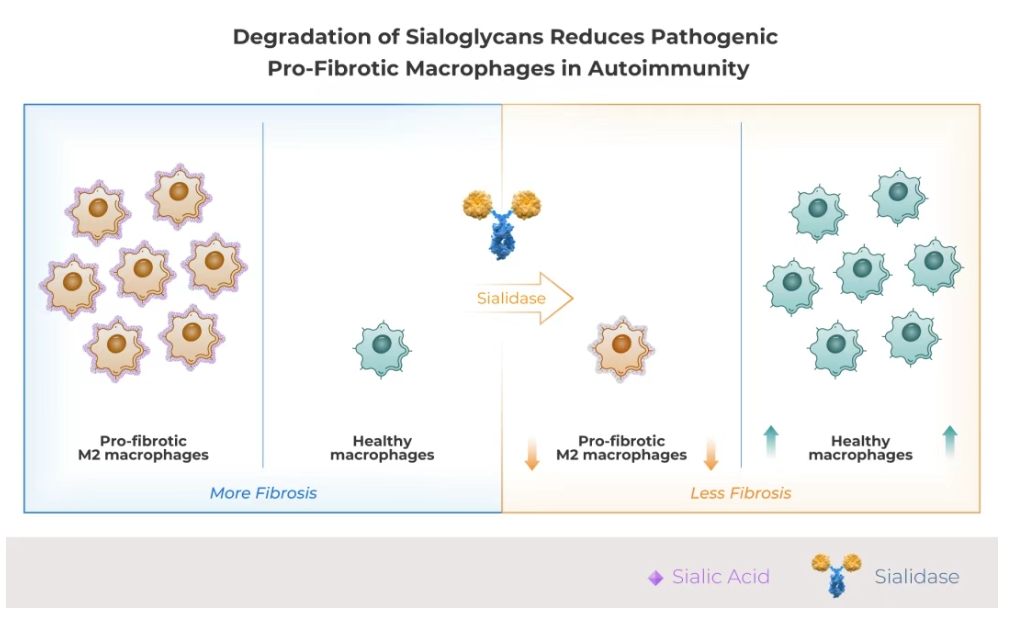
临床前研究表明,与利妥昔单抗单药相比,HLX79与利妥昔单抗联用的疗效显著提升,且不会引发CAR-T疗法或T细胞结合剂相关的细胞因子释放综合征(CRS)或免疫效应细胞相关神经毒性综合征(ICANS)。在此前的临床试验中,HLX79展现出良好的安全性特征,无剂量限制性毒性。HLX79联用利妥昔单抗有望为活动期肾小球肾炎患者带来临床获益。
未来,南宫NG28医药还将持续立足于未满足的临床需求,充分发挥公司在抗体药物领域的一体化平台优势,不断拓展疾病领域和新分子类型,为全球患者带来更多高质量、可负担的创新治疗方案。
参考文献
[1] 中华医学会肾脏病学分会专家组. 利妥昔单抗在肾小球肾炎中应用的专家共识[J]. 中华肾脏病杂志, 2022, 38(2):151-160.
[2] IQVIA《中国终末期肾病白皮书》
关于HLX01HLX79-GN201
本研究为一项双盲、随机对照、多中心的2期临床试验,旨在评估HLX79联合汉利康®对比安慰剂在活动期肾小球肾炎(狼疮肾炎(LN)和膜性肾病(MN))患者中的有效性、安全性和耐受性。研究分为两个阶段,第一阶段为剂量递增期,按照剂量递增设计原则,合格的受试者将每周一次接受HLX79(10 mg/kg、20 mg/kg或30 mg/kg)联合汉利康®或汉利康®安慰剂(375 mg/m2)给药,主要研究目的为评价HLX79联合汉利康®对比安慰剂联合汉利康®治疗活动期肾小球肾炎的安全性和耐受性;第二阶段为初步疗效探索期,筛选合格的受试者将按照2:2:1:1的比例,每周一次接受HLX79(高剂量/低剂量)联合汉利康®(375 mg/m2)、HLX79安慰剂联合汉利康®、或HLX79安慰剂联合汉利康®安慰剂给药,主要研究目的为在标准治疗基础上,评价HLX79联合汉利康®、安慰剂联合汉利康®以及安慰剂治疗活动期肾小球肾炎的临床疗效,次要研究目的为评估其他临床疗效、安全性、耐受性、药代动力学(PK)特征和免疫原性,探索性目的为评估潜在生物标志物的动态变化。
